Всемирный день борьбы с туберкулёзом - 24 марта 2023 года
 Каждый год 24 марта отмечается Всемирный день борьбы с туберкулезом (ТБ). Он остается самым значительным в мире инфекционным заболеванием, которое ежегодно убивает около 1,7 миллиона человек и по статистике является девятой по счету наиболее частой причиной смерти во всем мире. Этот день является поводом для мобилизации политической и социальной приверженности делу ликвидации ТБ как проблемы общественного здравоохранения.
Каждый год 24 марта отмечается Всемирный день борьбы с туберкулезом (ТБ). Он остается самым значительным в мире инфекционным заболеванием, которое ежегодно убивает около 1,7 миллиона человек и по статистике является девятой по счету наиболее частой причиной смерти во всем мире. Этот день является поводом для мобилизации политической и социальной приверженности делу ликвидации ТБ как проблемы общественного здравоохранения.
Туберкулёз (от лат. tuberculum «бугорок») — широко распространённое в мире инфекционное заболевание человека и животных, вызываемое различными видами микобактерий из группы Mycobacterium tuberculosis complex (M. tuberculosis и другими близкородственными видами).[1] Туберкулёз обычно поражает лёгкие, реже затрагивая другие органы и системы. Mycobacterium tuberculosis передаётся воздушно-капельным путём при разговоре, кашле и чихании больного.[2] Чаще всего после инфицирования микобактериями заболевание протекает в бессимптомной, скрытой форме (тубинфицированность), но примерно один из десяти случаев скрытой инфекции, в конце концов, переходит в активную форму.[3]
Классические симптомы туберкулёза лёгких — длительный кашель с мокротой, иногда с кровохарканьем, появляющимся на более поздних стадиях, лихорадка, слабость, ночная потливость и значительное похудение.
Различают открытую и закрытую формы туберкулёза. При открытой форме в мокроте или в других естественных выделениях больного — моче, свищевом отделяемом, кале (как правило при туберкулёзе пищеварительного тракта, редко при туберкулёзе лёгочной ткани) обнаруживаются микобактерии туберкулёза. Открытой формой считаются также те виды туберкулеза органов дыхания, при которых, даже в отсутствие бактериовыделения, имеются явные признаки сообщения очага поражения с внешней средой: каверна (распад) в лёгком, туберкулёз бронха (особенно язвенная форма), бронхиальный или торакальный свищ, туберкулёз верхних дыхательных путей. Если больной не соблюдает гигиенических мер предосторожности, он может стать заразным для окружающих. При «закрытой» форме туберкулёза микобактерии в мокроте доступными методами не обнаруживаются, больные такой формой эпидемиологически не опасны или малоопасны для окружающих.
Диагностика туберкулёза основана на флюорографии, рентгенографии и компьютерной томографии поражённых органов и систем, микробиологическом исследовании различного биологического материала, кожной туберкулиновой пробе (реакции Манту), а также методе молекулярно-генетического анализа (метод ПЦР) и др. Лечение сложное и длительное, требующее приёма препаратов в течение минимум шести месяцев. Лиц, контактировавших с больным, обследуют рентгенологически или с помощью реакции Манту, с возможностью назначения профилактического лечения противотуберкулёзными препаратами.
Заметные сложности в лечении туберкулёза возникают при наличии устойчивости возбудителя к противотуберкулёзным препаратам основного и, реже, резервного ряда, которая может быть выявлена только при микробиологическом исследовании. Устойчивость к изониазиду и рифампицину также может быть установлена методом ПЦР. Профилактика туберкулёза основана на скрининговых программах, профосмотрах, а также на вакцинации детей вакциной БЦЖ или БЦЖ-М.
Существует мнение, что M. tuberculosis инфицирована примерно треть населения Земли,[4] и примерно каждую секунду возникает новый случай инфекции.[5] Доля людей, которые заболевают туберкулёзом каждый год во всем мире, не изменяется или снижается, однако из-за роста численности населения абсолютное число новых случаев продолжает расти.[5] В 2007 году насчитывалось 13,7 миллионов зарегистрированных случаев хронического активного туберкулёза, 9,3 миллиона новых случаев заболевания и 1,8 миллиона случаев смерти, главным образом в развивающихся странах.[6] Кроме того, всё больше людей в развитых странах заражаются туберкулёзом, потому что их иммунная система ослабевает из-за приёма иммуносупрессивных препаратов, злоупотребления психоактивными веществами и особенно при ВИЧ-инфекции. Распространение туберкулёза неравномерно по всему миру, около 80 % населения во многих азиатских и африканских странах имеют положительный результат туберкулиновых проб, и только среди 5—10 % населения США такой тест положителен.[1] По некоторым данным, на территории России тубинфицированность взрослого населения приблизительно в 10 раз выше, чем в развитых странах.[7]
Устаревшее название туберкулёза лёгких — чахо́тка (от слова чахнуть). В качестве названия туберкулёза почек и некоторых других внутренних паренхиматозных органов (печени, селезёнки), а также желёз (например, слюнных) ранее использовалось слово «бугорчатка». Наружный туберкулёз (кожи, слизистых, лимфоузлов) назывался золотухой.
Для человека заболевание является социально зависимым.[8] До XX века туберкулёз был практически неизлечим. В настоящее время разработана комплексная программа, позволяющая выявить и вылечить заболевание на ранних стадиях его развития.[9][10]

Исторические сведения
Ещё задолго до открытия природы инфекционных заболеваний предполагали, что туберкулёз — заразная болезнь. В вавилонском Кодексе Хаммурапи было закреплено право на развод с больной женой, у которой имелись симптомы лёгочного туберкулёза. В Индии, Португалии и Венеции были законы, требующие сообщать обо всех подобных случаях.
В XVII веке Франциск Сильвий впервые связал гранулёмы, обнаруженные в различных тканях при вскрытии трупа, с признаками чахотки.
В 1819 году французский врач Рене Лаэннек предложил метод аускультации лёгких, что имело большое значение в разработке методов диагностики туберкулёза.
В 1822 году английский врач Джеймс Карсон высказал идею и предпринял первую, правда, неудачную, попытку лечения лёгочного туберкулёза искусственным пневмотораксом (введением воздуха в плевральную полость).[11] Спустя шесть десятилетий, в 1882 году, итальянцу Карло Форланини удалось ввести этот метод в практику. В России искусственный пневмоторакс впервые применил А. Н. Рубель в 1910 году.
В 1863 году Герман Бремер основал в Германии туберкулёзный санаторий.
В 1865 году французский морской врач Жан-Антуан Вильмен наблюдал распространение туберкулёза на корабле от одного больного матроса. В доказательство инфекционной природы врач собрал мокроту больных и пропитал ею подстилку для морских свинок. Свинки заболевали туберкулёзом и умирали — исследователь доказал, что туберкулёз — заразная («вирулентная») болезнь. Инфекционную природу туберкулёза подтвердил немецкий патолог Юлиус Конгейм в 1879 году. Он помещал кусочки органов больных туберкулёзом в переднюю камеру глаза кролика и наблюдал образование туберкулёзных бугорков.
В 1868 году немецкий патолог Теодор Лангганс обнаружил в туберкулёзном бугорке гигантские клетки, позже названные в его честь.
В 1882 году в Германии Роберт Кох после 17 лет работы в лаборатории открыл возбудителя туберкулёза, которого назвали бациллой Коха (БК). Он обнаружил возбудителя при микроскопическом исследовании мокроты больного туберкулёзом после окраски препарата везувином и метиленовым синим. Впоследствии он выделил чистую культуру возбудителя и вызвал ею туберкулёз у подопытных животных. В настоящее время фтизиатры пользуются термином МБТ (микобактерия туберкулёза).
В 1882—1884 годах Франц Циль и Фридрих Нельсен (Германия) предложили эффективный метод окраски кислотоустойчивых микобактерий туберкулёза.
В 1887 году в Эдинбурге открыт первый противотуберкулёзный диспансер.
В 1890 году Роберт Кох впервые получил туберкулин, который описал как «водно-глицериновую вытяжку туберкулёзных культур». В диагностических целях Кох предложил делать подкожную пробу с введением туберкулина. На конгрессе врачей в Берлине Кох сообщил о возможном профилактическом и даже лечебном действии туберкулина, испытанного в опытах на морских свинках и применённого на себе и своей сотруднице (которая впоследствии стала его женой). Через год в Берлине было сделано официальное заключение о высокой эффективности туберкулина в диагностике, однако лечебные свойства туберкулина были названы противоречивыми, поскольку резко обострялось течение болезни.
В 1902 году в Берлине проведена первая Международная конференция по туберкулёзу.
В 1904 году А. И. Абрикосов опубликовал работы, в которых описал картину очаговых изменений в лёгких на рентгенограмме при начальных проявлениях туберкулёза у взрослых (очаг Абрикосова).
В 1907 году австрийский педиатр Клеменс Пирке предложил накожную пробу с туберкулином для выявления людей, инфицированных микобактерией туберкулёза, и ввёл понятие аллергии.
В 1910 году Шарль Манту (Франция) и Феликс Мендель (Германия) предложили внутрикожный метод введения туберкулина, который в диагностическом плане оказался чувствительнее накожного.
В 1912 году исследователь Антон Гон (Австро-Венгрия) описал обызвествлённый первичный туберкулёзный очаг (очаг Гона).
В 1919 году микробиолог Альбер Кальметт и ветеринарный врач Камиль Герен (оба — Франция) создали вакцинный штамм микобактерии туберкулёза для противотуберкулёзной вакцинации людей. Штамм был назван «бациллы Кальметта — Герена» (Bacilles Calmette-Guerin, BCG). Впервые вакцина БЦЖ была введена новорождённому ребёнку в 1921 году.
В 1925 году Кальметт передал профессору Л. А. Тарасевичу штамм вакцины БЦЖ, которая была названа БЦЖ-1. Через три года экспериментального и клинического изучения было установлено, что вакцина относительно безвредна. Смертность от туберкулёза среди вакцинированных детей в окружении бактерионосителей была меньше, чем среди невакцинированных. В 1928 году было рекомендовано вакцинировать БЦЖ новорождённых из очагов туберкулёзной инфекции. С 1935 года вакцинацию стали проводить в широких масштабах не только в городах, но и в сельской местности. В середине 1950-х вакцинация новорождённых стала обязательной. До 1962 года проводили в основном пероральную вакцинацию новорождённых, с 1962 года для вакцинации и ревакцинации стали применять более эффективный внутрикожный метод введения вакцины. В 1985 году для вакцинации новорождённых с отягощённым постнатальным периодом была предложена вакцина БЦЖ-М, которая позволяет уменьшить антигенную нагрузку вакцинируемых.
С середины 1930-х годов применяется эктомия поражённой туберкулёзом части лёгкого.
В 1943 году Зельман Ваксман совместно с Альбертом Шацем получил стрептомицин — первый противомикробный препарат, который оказывал бактериостатическое действие на микобактерии туберкулёза. Интересно отметить, что в первые несколько лет применения стрептомицин обладал крайне высокой противотуберкулёзной активностью: даже смыв с флакона, где до этого находился лиофизат препарата, давал клинический эффект. Но всего через 10 лет эффективность препарата существенно снизилась, а в настоящее время его клинический эффект минимален. К концу XX века спектр антибактериальных препаратов, применяемых во фтизиатрии, значительно расширился.
Эпидемиология
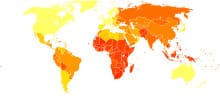
Усреднённые по возрасту годы жизни, скорректированные по нетрудоспособности, вызванные туберкулёзом на 100 000 жителей в 2004 году.[12]
нет данных ≤ 10 10—25 25—50 50—75 75—100 100—250 250—500 500—750 750—1000 1000—2000 2000—3000 ≥ 3000
В соответствии с информацией ВОЗ, около 2 миллиардов людей, треть общего населения Земли, инфицировано.[13] В настоящее время туберкулёзом ежегодно заболевает 9 миллионов человек во всём мире, из них 3 миллиона умирают от его осложнений. (По другим данным, ежегодно 8 миллионов заболевают туберкулёзом, а 2 миллиона умирает.[14])
На Украине в 1995 году ВОЗ объявила эпидемию туберкулёза.
Отмечено, что заболеваемость туберкулёзом зависит от неблагоприятных условий (стрессовой нагрузки), а также от индивидуальных характеристик организма человека (например, от группы крови и возраста заболевшего). Из числа заболевших в целом доминирует возрастная группа 18 — 26 лет.[15]
Однако, несмотря на этот факт, в странах, где заболеваемость туберкулёзом значительно снизилась — таких, как Америка — доминировать среди заболевших стала статистическая группа пожилых людей.[16]
Существует несколько факторов, вызывающих повышенную восприимчивость человека к туберкулёзу:
- Наиболее значимым в мире стал ВИЧ;
- Курение (особенно более 20 сигарет в день) — увеличивает вероятность туберкулёза в 2—4 раза[17];
- Диабет.[18]
Туберкулёз в России
В 2007 году в России отмечено 117 738 больных впервые выявленным туберкулёзом в активной форме (82,6 на 100 тыс. населения), что на 0,2 % выше, чем в 2006 г.
В 2009 году в России отмечено 105 530 случаев впервые выявленного активного туберкулёза (в 2008 г. — 107 988 случаев). Показатель заболеваемости туберкулёзом составил 74,26 на 100 тыс. населения (в 2008 г. — 75,79 на 100 тысяч).[19]
Наиболее высокие показатели заболеваемости в 2009 году, как и в предыдущие годы, отмечались в Дальневосточном (124,1), Сибирском (100,8), Уральском (73,6) федеральных округах. В пятнадцати субъектах Российской Федерации показатель заболеваемости в 1,5 и более раза превышает средний по стране: Еврейской автономной области (159,5), Амурской (114,4), Омской (112,0), Кемеровской (110,9), Иркутской (101,2), Новосибирской (98,10), Курганской (94,94), Сахалинской (94,06) областях, республиках Тыва (164,2), Бурятия (129,8), Хакасия (103,6), Алтай (97,45), Приморском (188,3) Хабаровском (110,0), Алтайском краях (102,1).
Среди всех впервые выявленных больных туберкулёзом бациллярные больные (бактериовыделители) в 2007 году составили 40 % (47 239 человек, показатель — 33,15 на 100 тыс. населения).
В России смертность от туберкулёза за 2007 год составила 18 человек на 100 тысяч жителей (на 7 % ниже, чем в 2006 г.), таким образом, в год умирает от туберкулёза около 25 000 человек (в среднем по Европе смертность от туберкулёза приблизительно в 3 раза меньше). В структуре смертности от инфекционных и паразитарных заболеваний в России доля умерших от туберкулёза составляет 70 %.[20]
Согласно официальной статистике, показатель смертности от туберкулеза в январе — сентябре 2011 года снизился на 7,2 % в сравнении с аналогичным периодом 2010 года[21].
Этиология
Основная статья: Mycobacterium tuberculosis
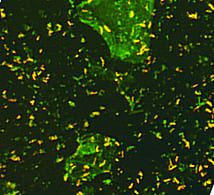
Флуоресцентная окраска МБТ
Возбудителями туберкулёза являются микобактерии — кислотоустойчивые бактерии рода Mycobacterium. Всего известно 74 вида микобактерий. Они широко распространены в почве, воде, среди людей и животных. Однако туберкулёз у человека вызывает условно выделенный комплекс, включающий в себя Mycobacterium tuberculosis (человеческий вид), Mycobacterium bovis (бычий вид), Mycobacterium africanum, Mycobacterium bovis BCG (БЦЖ-штамм бычьего вида), Mycobacterium microti, Mycobacterium canettii. В последнее время к нему отнесены Mycobacterium pinnipedii, Mycobacterium caprae, филогенетически имеющие отношение к Mycobacterium microti и Mycobacterium bovis.
Туберкулёз, вызванный различными видами микобактерий, достаточно сильно различается между собой. Основной видовой признак микобактерии туберкулёза (МБТ) — патогенность, которая проявляется в вирулентности. Вирулентность может существенно изменяться в зависимости от факторов внешней среды и по-разному проявляться в зависимости от состояния макроорганизма, который подвергается бактериальной агрессии.
Патогенез и патологическая анатомия
В пораженных туберкулёзом органах (лёгкие, мочеполовая система, лимфатические узлы, кожа, кости, кишечник и др.) развивается специфическое «холодное» туберкулёзное воспаление, носящее преимущественно гранулематозный характер и приводящее к образованию множественных бугорков со склонностью к распаду.
Первичное инфицирование микобактериями туберкулёза и скрытое течение туберкулёзной инфекции
Первичный туберкулёзный комплекс
Большое значение имеет первичная локализация инфекционного очага. Различают следующие пути передачи туберкулёза:
- Воздушно-капельный. Туберкулёзные микобактерии попадают в воздух с капельками при кашле, разговоре и чихании больного активным туберкулёзом. При вдыхании эти капельки с микобактериями попадают в лёгкие здорового человека. Это самый распространённый путь заражения.
- Алиментарный. Проникновение происходит через пищеварительный тракт. Специальные эксперименты на животных показывают, что при алиментарном способе требуется значительно большее количество микобактерий, чем при аэрогенном заражении. Если при вдыхании достаточно одной или двух микобактерий, то для заражения через пищу требуются сотни микробов.
- Контактный. Описаны случаи заражения через конъюнктиву глаза маленьких детей и взрослых. При этом иногда обнаруживается острый конъюнктивит и воспаление слёзного мешочка. Заражение туберкулёзом через кожу встречается редко.
- Внутриутробное заражение туберкулёзом. Возможность заражения туберкулёзом плода в период внутриутробной жизни установлена у группы детей, умерших в первые дни после рождения. Заражение происходит или при поражении туберкулёзом плаценты, или при инфицировании повреждённой плаценты во время родов больной туберкулёзом матерью. Такой путь заражения туберкулёзом встречается крайне редко.
Система дыхания защищена от проникновения микобактерий мукоцилиарным клиренсом (выделение бокаловидными клетками дыхательных путей слизи, которая склеивает поступившие микобактерии, и дальнейшая элиминация микобактерий с помощью волнообразных колебаний мерцательного эпителия). Нарушение мукоцилиарного клиренса при остром и хроническом воспалении верхних дыхательных путей, трахеи и крупных бронхов, а также под воздействием токсических веществ делает возможным проникновение микобактерий в бронхиолы и альвеолы, после чего вероятность инфицирования и заболевания туберкулёзом значительно увеличивается.
Возможность заражения алиментарным путём обусловлена состоянием стенки кишечника и его всасывающей функции.
Возникновение клинически выраженного туберкулёза
В случае недостаточной активации макрофагов фагоцитоз неэффективен, размножение МБТ макрофагами не контролируется и потому происходит в геометрической прогрессии. Фагоцитирующие клетки не справляются с объёмом работы и массово гибнут. При этом в межклеточное пространство поступает большое количество медиаторов и протеолитических ферментов, которые повреждают прилежащие ткани. Происходит своеобразное «разжижение» тканей, формируется особая питательная среда, способствующая росту и размножению внеклеточно расположенных МБТ.
Большая популяция МБТ нарушает баланс в иммунной защите: количество Т-супресоров (CD8+) растёт, иммунологическая активность Т-хелперов (CD4+) падает. Сначала резко усиливается, а затем ослабевает ГЗТ к антигенам МБТ. Воспалительная реакция приобретает распространённый характер. Повышается проницаемость сосудистой стенки, в ткани поступают белки плазмы, лейкоциты и моноциты. Формируются туберкулёзные гранулёмы, в которых преобладает казеозный некроз. Усиливается инфильтрация наружного слоя полинуклеарными лейкоцитами, макрофагами и лимфоидными клетками. Отдельные гранулёмы сливаются, общий объём туберкулёзного поражения увеличивается. Первичное инфицирование трансформируется в клинически выраженный туберкулёз.
Клинические формы туберкулёза
Чаще всего туберкулёз поражает органы дыхательной (главным образом лёгкие и бронхи) и мочеполовой систем. При костно-суставных формах туберкулёза наиболее часто встречаются поражения позвоночника и костей таза. Ввиду этого различают два основных вида туберкулёза: туберкулёз лёгких и внелёгочный туберкулёз.
Туберкулёз лёгких
Основная статья: Туберкулёз лёгких
Туберкулёз лёгких может принимать различные формы:
- первичный туберкулёзный комплекс (очаг туберкулёзной пневмонии + лимфангит, лимфаденит средостения)
- туберкулёзный бронхоаденит, изолированный лимфаденит внутригрудных лимфатических узлов.
Исходя из степени распространённости туберкулёза лёгких, различают:
- латентный туберкулёз;
- диссеминированный туберкулёз;
- милиарный туберкулёз;
- очаговый (ограниченный) туберкулёз;
- инфильтративный туберкулёз;
- казеозная пневмония;
- туберкулёма;
- кавернозный туберкулёз;
- фиброзно-кавернозный туберкулёз;
- цирротический туберкулёз.
Гораздо реже встречаются туберкулёз плевры, туберкулёз гортани, трахеи.
Внелёгочный туберкулёз
Внелёгочный туберкулёз может локализоваться в любом органе человека. Различают следующие формы внелёгочного туберкулёза:
- Туберкулёз органов пищеварительной системы — чаще всего поражаются дистальный отдел тонкой кишки и слепая кишка;
- Туберкулёз органов мочеполовой системы — поражение почек, мочевыводящих путей, половых органов;
- Туберкулёз центральной нервной системы и мозговых оболочек — поражение спинного и головного мозга, твёрдой оболочки головного мозга (туберкулёзный менингит);
- Туберкулёз костей и суставов — чаще всего поражаются кости позвоночника;
- Туберкулёз кожи;
- Туберкулёз глаз.
Основные клинические проявления
 «Рождение Венеры», деталь, XV век. Флорентийка Симонетта Веспуччи, с которой написана Венера, умерла в возрасте 22 лет от туберкулёза.[26] Видимое на картине резко опущенное левое плечо даёт основания предполагать, что у натурщицы имело место туберкулёзное поражение плечевого пояса.[27]
«Рождение Венеры», деталь, XV век. Флорентийка Симонетта Веспуччи, с которой написана Венера, умерла в возрасте 22 лет от туберкулёза.[26] Видимое на картине резко опущенное левое плечо даёт основания предполагать, что у натурщицы имело место туберкулёзное поражение плечевого пояса.[27]
Туберкулёз лёгких может длительное время протекать бессимптомно или малосимптомно и обнаружиться случайно при проведении флюорографии или на рентгеновском снимке грудной клетки. Факт обсеменения организма туберкулёзными микобактериями и формирования специфической иммунологической гиперреактивности может быть также обнаружен при постановке туберкулиновых проб.
В случаях, когда туберкулёз проявляется клинически, обычно самыми первыми симптомами выступают неспецифические проявления интоксикации: слабость, бледность, повышенная утомляемость, вялость, апатия, субфебрильная температура (около 37 °C, редко выше 38°), потливость, особенно беспокоящая больного по ночам, похудение. Часто выявляется генерализованная или ограниченная какой-либо группой лимфатических узлов лимфаденопатия — увеличение размеров лимфатических узлов. Иногда при этом удаётся выявить специфическое поражение лимфатических узлов — «холодное» воспаление.
В крови больных туберкулёзом или обсеменённых туберкулёзной микобактерией при лабораторном исследовании часто обнаруживается анемия (снижение числа эритроцитов и содержания гемоглобина), умеренная лейкопения (снижение числа лейкоцитов). Некоторыми специалистами предполагается, что анемия и лейкопения при туберкулёзной инфекции — последствие воздействия токсинов микобактерий на костный мозг. Согласно другой точке зрения, всё обстоит строго наоборот — туберкулёзная микобактерия преимущественно «нападает» в основном на ослабленных лиц — не обязательно страдающих клинически выраженными иммунодефицитными состояниями, но, как правило, имеющих слегка пониженный иммунитет; не обязательно страдающих клинически выраженной анемией или лейкопенией, но имеющих эти параметры около нижней границы нормы и т. д. В такой трактовке анемия или лейкопения — не прямое следствие туберкулёзной инфекции, а, наоборот, предусловие её возникновения и предсуществовавший до болезни (преморбидный) фактор.
Далее по ходу развития заболевания присоединяются более или менее явные симптомы со стороны пораженного органа. При туберкулёзе лёгких это кашель, отхождение мокроты, хрипы в лёгких, насморк, иногда затруднение дыхания или боли в грудной клетке (указывающие обычно на присоединение туберкулёзного плеврита), кровохарканье. При туберкулёзе кишечника — те или иные нарушения функции кишечника, запоры, поносы, кровь в кале и т. д. Как правило (но не всегда), поражение лёгких бывает первичным, а другие органы поражаются вторично путём гематогенного обсеменения. Но встречаются случаи развития туберкулёза внутренних органов или туберкулёзного менингита без каких-либо текущих клинических или рентгенологических признаков поражения лёгких и без такового поражения в анамнезе.
Профилактика
Проба Манту
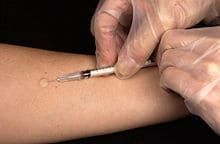 Основной профилактикой туберкулёза на сегодняшний день является вакцина БЦЖ (BCG). Она надёжно защищает от самой опасной формы туберкулёза — туберкулёзного менингита[28], но при наличии противопоказаний в некоторых случаях сама может способствовать развитию костно-суставного туберкулёза[29], а у ВИЧ-инфицированных и больных СПИД — и других видов туберкулёза[30]. В соответствии с «Национальным календарём профилактических прививок» прививку делают в роддоме при отсутствии противопоказаний в первые 3—7 дней жизни ребенка. В 7 и 14 лет при отрицательной реакции Манту и отсутствии противопоказаний проводят ревакцинацию.
Основной профилактикой туберкулёза на сегодняшний день является вакцина БЦЖ (BCG). Она надёжно защищает от самой опасной формы туберкулёза — туберкулёзного менингита[28], но при наличии противопоказаний в некоторых случаях сама может способствовать развитию костно-суставного туберкулёза[29], а у ВИЧ-инфицированных и больных СПИД — и других видов туберкулёза[30]. В соответствии с «Национальным календарём профилактических прививок» прививку делают в роддоме при отсутствии противопоказаний в первые 3—7 дней жизни ребенка. В 7 и 14 лет при отрицательной реакции Манту и отсутствии противопоказаний проводят ревакцинацию.
С целью выявления туберкулёза на ранних стадиях, всем взрослым необходимо проходить флюорографическое обследование в поликлинике не реже 1 раза в год (в зависимости от профессии, состояния здоровья и принадлежности к различным «группам риска»). Также при резком изменении реакции Манту по сравнению с предыдущей (т. н. «вираже»), фтизиатром может быть предложено провести профилактическую химиотерапию несколькими препаратами, как правило, в комплексе с гепатопротекторами и витаминами группы B.[31] У некоторых взрослых и примерно у 10 % детей, не прошедших курс профилактического лечения в период виража, развивается состояние, именуемое туберкулёзной интоксикацией.
Лечение туберкулёза
Основная статья: Лечение туберкулёза
Лечение туберкулёза, особенно внелёгочных его форм, является сложным делом, требующим много времени и терпения, а также комплексного подхода.
Фактически с самого начала применения антибиотикотерапии возник феномен лекарственной устойчивости. Феномен обусловлен тем, что микобактерия не имеет плазмид, а популяционная устойчивость микроорганизмов к антибактериальным препаратам традиционно описывалась в микробной клетке наличием R-плазмид (от англ. resistance — устойчивость). Однако, несмотря на этот факт, отмечалось появление или исчезновение лекарственной устойчивости у одного штамма МБТ. В итоге выяснилось, что за активацию или дезактивацию генов, отвечающих за резистентность, ответственны IS-последовательности.
Виды лекарственной устойчивости у возбудителя туберкулёза
Различают лекарственную устойчивость:
- первичную;
- приобретённую.
К микроорганизмам с первичной устойчивостью относят штаммы, выделенные от пациентов, не получавших ранее специфическую терапию или получавших препараты в течение месяца или меньше. При невозможности уточнения факта применения противотуберкулёзных препаратов используют термин «начальная устойчивость». Если устойчивый штамм выделен у пациента на фоне противотуберкулёзной терапии, проводимой в течение месяца и более, устойчивость расценивают как «приобретённую». Частота первичной лекарственной устойчивости характеризует эпидемиологическое состояние популяции возбудителя туберкулёза. Приобретённая лекарственная устойчивость среди впервые выявленных больных считается результатом неудачного лечения — то есть действовали факторы, приводящие к снижению системной концентрации химиопрепаратов в крови и их эффективности, одновременно «запуская» в клетках микобактерий защитные механизмы.
В структуре лекарственной устойчивости микобактерий туберкулёза различают:
- Монорезистентность — устойчивость к одному из противотуберкулёзных препаратов, чувствительность к другим препаратам сохранена. При применении комплексной терапии монорезистентность выявляют довольно редко и, как правило, к стрептомицину (в 10—15 % случаев среди впервые выявленных больных).
- Полирезистентность — устойчивость к двум и более препаратам.
- Множественная лекарственная устойчивость (МЛУ) — устойчивость к изониазиду и рифампицину одновременно (независимо от наличия устойчивости к другим препаратам). Она сопровождается, как правило, устойчивостью к стрептомицину и др. В настоящее время МЛУ возбудителей туберкулёза стала эпидемиологически опасным явлением. Расчёты показывают, что выявление возбудителей с МЛУ более чем в 6,6 % случаев (среди впервые выявленных больных) требует изменения стратегии Национальной противотуберкулёзной программы. В России, по данным мониторинга лекарственной устойчивости, частота МЛУ среди впервые выявленных больных составляет от 4 до 15 %, среди рецидивов — 45—55 %, а среди случаев неудачного лечения — до 80 %.
- Суперустойчивость — множественная лекарственная устойчивость в сочетании с устойчивостью к фторхинолонам и к одному из инъекционных препаратов (канамицин, амикацин, капреомицин). Туберкулёз, вызванный штаммами с суперустойчивостью, представляет прямую угрозу для жизни пациентов, так как остальные противотуберкулёзные препараты второго ряда не имеют выраженного эффекта. С 2006 года в некоторых странах организовано наблюдение за распространением штаммов микобактерий с суперустойчивостью. За рубежом принято обозначать этот вариант МЛУ как XDR (Extreme drug resistance).
- Перекрёстная устойчивость — когда возникновение устойчивости к одному препарату влечет за собой устойчивость к другим препаратам. У M. tuberculosis, как правило, ассоциированные с устойчивостью мутации не взаимосвязаны. Особенно часто перекрёстную устойчивость выявляют внутри одной группы препаратов, например аминогликозидов, что обусловлено одинаковой «мишенью» данной группы препаратов. В ежегодном отчете ВОЗ отмечен резкий всплеск множественной полирезистентности среди «Пекинского» («Beijing») штамма. Общемировой тенденцией является снижение эффективности антибактериальных препаратов.
На сегодняшний день основой лечения туберкулёза является поликомпонентная противотуберкулёзная химиотерапия (J04 Противотуберкулёзные препараты).
Трёхкомпонентная схема лечения
На заре противотуберкулёзной химиотерапии была выработана и предложена трёхкомпонентная схема терапии первой линии:
- стрептомицин
- изониазид
- пара-аминосалициловая кислота (ПАСК).
Эта схема стала классической. Она царствовала во фтизиатрии долгие десятилетия и позволила спасти жизни огромному числу больных туберкулёзом, однако на сегодняшний день исчерпала себя в виду высокой токсичности ПАСК и невозможности длительного применения стрептомицина.
Четырёхкомпонентная схема лечения
Одновременно в связи с повышением устойчивости выделяемых от больных штаммов микобактерий возникла необходимость усиления режимов противотуберкулёзной химиотерапии. В результате была выработана четырёхкомпонентная схема химиотерапии первой линии (DOTS — стратегия, используется при инфицировании достаточно чувствительными штаммами):
- рифампицин или рифабутин
- изониазид
- пиразинамид
- этамбутол
Вместо этамбутола в схеме противотуберкулезной терапии первого ряда иногда применяется стрептомицин, а практикующееся в странах бывшего СССР применение канамицина в схеме первого ряда является недопустимым с точки зрения ВОЗ, так как его применение в таких случаях может привести к развитию устойчивых к аминогликозидам штаммов микобактерий.
Эта схема была разработана Карелом Стибло (Нидерланды) в 1980-х гг. На сегодняшний день система лечения т. н. препаратами первого ряда (включая изониазид, рифампицин, пиразинамид и этамбутол) является общепринятой в 120 странах мира, включая развитые страны.
Пятикомпонентная схема лечения
Во многих центрах, специализирующихся на лечении туберкулёза, сегодня предпочитают применять ещё более мощную пятикомпонентную схему, добавляя к упомянутой выше четырёхкомпонентной схеме производное фторхинолона, например, ципрофлоксацин. Включение препаратов второго, третьего и следующих поколений является основным при лечении лекарственноустойчивых форм туберкулёза. Режим лечения препаратами второго и следующих поколений подразумевает как минимум 20 месяцев ежедневного приёма препаратов. Данный режим гораздо дороже, чем лечение препаратами первого ряда, и составляет эквивалент примерно в 25 000 долларов США на весь курс. Существенно ограничивающим моментом также является наличие огромного количества различного рода побочных эффектов от применения препаратов второго и следующих поколений.
Если, несмотря на 4—5-компонентный режим химиотерапии, микобактерии всё же развивают устойчивость к одному или нескольким применяемым химиопрепаратам, то применяют химиопрепараты второй линии: циклосерин, капреомицин и другие, относящиеся ко второму (резервному) ряду вследствие своей токсичности для человеческого организма.
Кроме химиотерапии, большое внимание должно уделяться интенсивному, качественному и разнообразному питанию больных туберкулёзом, набору массы тела при пониженной массе, коррекции гиповитаминозов, анемии, лейкопении (стимуляции эритро- и лейкопоэза). Больные туберкулёзом, страдающие алкоголизмом или наркотической зависимостью, должны пройти детоксикацию до начала противотуберкулёзной химиотерапии.
Больным туберкулёзом, получающим иммуносупрессивные препараты по каким-либо показаниям, стремятся снизить их дозы или совсем отменить их, уменьшив степень иммуносупрессии, если это позволяет клиническая ситуация по заболеванию, потребовавшему иммуносупрессивной терапии. Больным ВИЧ-инфекцией и туберкулёзом показана специфическая анти-ВИЧ терапия параллельно с противотуберкулёзной, а также противопоказано применение рифампицина.[32]
Глюкокортикоиды в лечении туберкулёза применяют очень ограниченно в связи с их сильным иммуносупрессивным действием. Основными показаниями к назначению глюкокортикоидов являются сильное, острое воспаление, выраженная интоксикация и др. При этом глюкокортикоиды назначают на достаточно короткий срок, в минимальных дозах и только на фоне мощной (5-компонентной) химиотерапии.
Очень важную роль в лечении туберкулёза играет также санаторно-курортное лечение. Давно известно, что микобактерии туберкулёза не любят хорошей оксигенации и предпочитают селиться в сравнительно плохо оксигенируемых верхушечных сегментах долей лёгких. Улучшение оксигенации лёгких, наблюдаемое при интенсификации дыхания в разрежённом воздухе горных курортов, способствует торможению роста и размножения микобактерий. С той же целью (создания состояния гипероксигенации в местах скопления микобактерий) иногда применяют гипербарическую оксигенацию и др.
Сохраняют своё значение и хирургические методы лечения туберкулёза: в запущенных случаях может оказаться полезным наложение искусственного пневмоторакса и пневмоперитонеума, удаление поражённого лёгкого или его доли, дренирование каверны, эмпиемы плевры и др. Однако безусловным и важнейшим действенным средством является химиотерапия — терапия противотуберкулёзными препаратами, гарантирующими бактериостатический, бактериолитический эффекты, без которых невозможно достижение излечения от туберкулёза.
Специфическая профилактика. Вакцинация и ревакцинация.
В нашей стране в родильных домах проводят обязательную вакцинацию БЦЖ всех новорожденных, кроме тех, у кого имеются противопоказания. Вакцинацию осуществляет специально обученный средний медицинский персонал, имеющий соответствующее удостоверение.
Вакцинируют здоровых новорожденных на 4 —7-й день жизни. Противопоказаниями к вакцинации являются:
- Недоношенность — масса тела менее 2500 г (вакцинируют вакциной БЦЖ-М);
- Внутриутробная инфекция, сепсис (после выздоровления через 6 мес); гнойно-воспалительные заболевания кожных покровов (после выздоровления через 1 мес); гемолитическая болезнь новорожденных (не ранее, чем через 6 мес. после выздоровления); тяжелые родовые травмы с неврологической симптоматикой (после выздоровления по заключению врача-невропатолога через 3 мес); острые заболевания (не ранее, чем через 1 мес. после выздоровления); врожденные ферментопатии;
- Иммунодефицитные состояния (первичные);
- Генерализованная инфекция БЦЖ, выявленная у других ранее родившихся детей в семье;
- ВИЧ-инфекция у матери.
Вакцинацию новорожденных с массой тела 2000 г проводят вакциной БЦЖ-М в родильном доме в те же сроки, недоношенных и родившихся с низкой массой тела — в отделениях выхаживания недоношенных новорожденных по достижении массы тела 2300 г перед выпиской из стационара.
Дети, не вакцинированные против туберкулеза в родильном доме, должны быть привиты вакциной БЦЖ-М в течение 1 — 6 мес. жизни после выздоровления. Детям в возрасте 2 мес. и старше перед вакцинацией производят туберкулиновую пробу и прививки делают только при ее отрицательных результатах.
Вакцина БЦЖ (BCG) была получена Calmette и Guerin в 1919 г. в результате многократных пассажей Mycobacterium bovis, изолированных в 1902 г. во Франции Nocard. Вакцина не вызывает у человека прогрессирующего туберкулеза, но способствует развитию приобретенного иммунитета.
Вакцина БЦЖ — живая вакцина, и ее протективный эффект зависит от достаточного количества живых микобактерий, которые размножаются в организме привитого человека. При выраженном иммунодефиците может развиться генерализованная инфекция БЦЖ с различными проявлениями болезни, но это встречается очень редко.
Таким образом, препарат представляет собой лиофилизированные живые микобактерии штамма БЦЖ-1, имеющие вид высушенной массы белого цвета. Одна ампула содержит (1 ±0,01) мг вакцины БЦЖ, т.е. 20 доз по 0,05 мг.
Препарат вакцины БЦЖ-М — это также живые лиофилизированные микобактерии штамма БЦЖ-1, но в одной ампуле содержится 0,5 + 0,01 мг вакцины, что составляет 20 доз по 0,025 мг. Для поддержания жизнеспособности микобактерий вакцину необходимо хранить в холодильнике при температуре не выше +4 "С, срок годности 1 год. Для осуществления вакцинации необходимо сухую вакцину развести изотоническим (0,9%-м) раствором натрия хлорида. В ампулу с вакциной вводят 2 мл этого раствора, что позволяет получить в объеме 0,1 мл раствора дозу вакцины БЦЖ 0,05 мг. Разведенная вакцина сразу же должна быть использована по назначению.
В исключительных случаях разведенную вакцину можно использовать в течение 2 —3 ч при условии строгого соблюдения стерильности и защиты от солнечного или дневного света. Вакцину БЦЖ вводят внутрикожно в дозе 0,1 мл в область плеча на границе верхней и средней третей, при этом образуется папула диаметром 5 — 6 мм, которая через 15 — 20 мин исчезает. Спустя 4 — 6 нед. у ребенка в месте введения вакцины появляется прививочная реакция в виде инфильтрата диаметром 5—10 мм с небольшим узелком в центре, покрытого корочкой; у некоторых привитых образуется пустула с последующим некрозом и незначительным серозным отделяемым. В течение 2 — 4 мес. происходит постепенная инволюция пустулы с образованием рубца округлой формы диаметром 2—10 мм. Сведения о вакцинации записываются в историю развития ребенка: дата, вид вакцины, серия, доза и прививочные реакции в 1-, 3-, 12-месячном возрасте. Эти же сведения дублируются в «карте профилактических прививок».
Другие прививки новорожденному ребенку начинают проводить через 3 мес. после вакцинации БЦЖ (БЦЖ-М), если в месте введения вакцины отсутствует пустула и образовалась корочка. При наличии пустулы через фтизиопедиатра оформляется временный медотвод от прививок.
В последующем другие прививки могут быть проведены с интервалом не менее 2 мес. до и после вакцинации БЦЖ. Наличие осложненного течения БЦЖ является временным противопоказанием от других прививок. Осложнения после вакцинации БЦЖ отмечаются сравнительно редко (0,02 % случаев). Осложнения делятся на четыре категории: 1-я категория — локальные кожные поражения (подкожные инфильтраты, холодные абсцессы, язвы) и регионарные лимфадениты; 2-я категория — персистирующие и дессиминированная БЦЖ-инфекция без летального исхода (волчанка, оститы и др.); 3-я категория — дессиминированная БЦЖ-инфекция, генерализован-ное поражение с летальным исходом, которое отмечают при врожденном иммунодефиците; 4-я категория — пост-БЦЖ-синдром (проявление заболевания, возникшего вскоре после вакцинации БЦЖ,- главным образом аллергического характера: узловатая эритема, кольцевидная гранулема, сыпи и т.п.). После постановки диагноза «осложнение» на месте введения вакцины БЦЖ незамедлительно ставят в известность руководителя медицинского учреждения и направляют экстренное извещение в центр государственного эпидемиологического надзора; составляют «Карту регистрации больного с осложнениями после иммунизации туберкулезной вакциной» и направляют в Республиканский центр по осложнениям противотуберкулезной вакцины Минздрава России при НИИ фтизиопульмонологии Минздрава России; обо всех случаях осложнений и необычных реакций и несоответствиях физических свойств туберкулезной вакцины сообщают в ГИСК им. Л. А.Тарасевича Минздрава России. Иммунитет, приобретенный после вакцинации, развивается в течение 6 — 8 нед., в этот же период появляется поствакцинальная сенсибилизация к туберкулину, проявляющаяся положительной туберкулиновой реакцией. Наличие поствакцинального рубчика и положительная туберкулиновая реакция у привитых свидетельствуют о технически правильно выполненной вакцинации. Протективный эффект противотуберкулезной вакцинации — 80%, т.е. из каждых 100 привитых у 80 локальные проявления туберкулеза при заражении не развиваются. Протективный эффект после вакцинации сохраняется в среднем в течение 10 лет, поэтому в нашей стране принято, кроме вакцинации новорожденных, проводить ревакцинацию детей и подростков. Первую ревакцинацию проводят в 6 —7-летнем возрасте (учащиеся 1-го класса школы), вторую — в 11 —12-летнем возрасте (учащиеся 5-го класса), третью ревакцинацию — в 16— 17-летнем возрасте (учащиеся перед окончанием школы). На территориях, на которых практически ликвидирована заболеваемость детей туберкулезом, при наличии специального приказа местных органов здравоохранения разрешается осуществлять только две ревакцинации: первую — детям в 7-летнем возрасте (учащимся 1 —2-го класса), вторую — в 14—15-летнем возрасте (учащимся 8-го класса). Ревакцинацию проводят также взрослым лицам до 30 лет. Чаще всего это удается в организованных коллективах: студенты высших учебных заведений, допризывники и призванные на службу в вооруженных силах, внутренних войсках, милиции, рабочие крупных заводов и т.д. Перед ревакцинацией осуществляют туберкулинодиагностику — внутрикожный туберкулиновый тест (проба Манту) с 2ТЕ — ППД-Л. Ревакцинацию производят только лицам, у которых получены отрицательные результаты туберкулиновой пробы. В сложной эпидемической обстановке при наличии большого резервуара инфекции и высокой заболеваемости ревакцинация возможна при сомнительных результатах туберкулиновой пробы и даже без предварительной туберкулинодиагностики — «прямая» ревакцинация.
Противопоказаниями к ревакцинации БЦЖ являются:
- инфицированность туберкулезом или туберкулез в прошлом;
- осложненные реакции на предыдущее введение вакцины БЦЖ или БЦЖ-М (келоидные рубцы, лимфадениты и др.);
- острые заболевания (инфекционные и неинфекционные), включая период реконвалесценции, хронические заболевания в стадии обострения или декомпенсации, аллергические болезни (прививки проводят не ранее 1 мес. после выздоровления или ремиссии);
- иммунодефицитные состояния, злокачественные новообразования любой локализации. При назначении иммунодепрессантов и лучевой терапии прививку проводят не ранее, чем через 6 мес. после окончания лечения;
- положительные и сомнительные реакции Манту с 2ТЕ ППД-Л.
Организация вакцинации новорожденных и ревакцинации является одной из основных задач противотуберкулезного диспансера и связана с планированием всего комплекса мероприятий, подготовкой медицинского персонала и обеспечением необходимым инструментарием, вакциной, туберкулином и т.д.
При планировании вакцинации следует предусмотреть вакцинацию 96 —97 % новорожденных благодаря рациональному использованию вакцины БЦЖ и БЦЖ-М. На ряде территорий вакцинацию новорожденных проводят только вакциной БЦЖ-М.
Ревакцинация требует тщательной организационной подготовки, так как она включает проведение массовой туберкулинодиагностики, регистрацию результатов туберкулиновых реакций через 48 ч после туберкулиновой пробы, отбор контингентов для ревакцинации и ее выполнение. Этот комплекс мероприятий целесообразнее проводить силами специально подготовленных бригад, состоящих из средних медицинских работников детских городских, городских и центральных районных поликлиник. В состав бригады должны входить не менее двух медицинских сестер, регистратор и другой дополнительный персонал; как правило, в состав бригады включают медицинского работника учреждения, в котором проводят ревакцинацию. Если вакцинацию новорожденных осуществляют постоянно в родильных домах, то бригады по ревакцинации работают по заранее составленному плану-графику, в котором указано время выхода в каждый конкретный детский и подростковый коллектив.
За полный охват контингентов, которым необходимо сделать противотуберкулезные прививки, качество и эффективность противотуберку-лезной вакцинации и ревакцинации детей, подростков и взрослых несут ответственность главные врачи gротивотуберкулез-ного диспансера, санитарно-эпидемиологической станции, центральной и районной поликлиник. Основными документами, которыми необходимо руководствоваться при проведении противотуберкулезных прививок, являются «Инструкция по вакцинации и ревакцинации против туберкулеза БЦЖ и БЦЖ-М» (приложение № 5 к приказу Минздрава России № 109 от 21.03.2003 г.). Ревакцинацию проводят по месту учебы под контролем врача общей практики. Неорганизованные дети ревакцинируются в прививочном кабинете поликлиники.
Прогноз
Прогноз заболевания во многом зависит от стадии, локализации заболевания, лекарственной устойчивости возбудителя и своевременности начала лечения, однако в целом является условно неблагоприятным[33]. Заболевание без усиленного диетического питания, благоприятных социально-гигиенических условий, климатолечения плохо поддаётся химиотерапии, особенно это касается туберкулёза с множественной лекарственной устойчивостью и широкой лекарственной устойчивостью, а хирургическое лечение зачастую является симптоматическим или паллиативным. Трудоспособность во многих случаях стойко утрачивается, и даже при сохранённой после излечения трудоспособности существует запрет на трудовую деятельность подобных лиц по целому ряду декретированных профессий, таких как учителя младших классов, воспитатели детских садов, сотрудники пищевой промышленности или коммунальных служб и т. п. Своевременно начатое лечение позволяет добиться полного восстановления трудоспособности, однако не гарантирует невозможность рецидива заболевания. При несвоевременной диагностике или неаккуратном лечении происходит инвалидизация пациента, зачастую в итоге приводящая к его смерти.
Литература:
1. Kumar, Vinay; Abbas, Abul K.; Fausto, Nelson; & Mitchell, Richard N. Robbins Basic Pathology. — 8th. — Saunders Elsevier, 2007. — P. 516–522. — ISBN 978-1-4160-2973-1.
2. Konstantinos, A (2010). «Testing for tuberculosis». Australian Prescriber, 33:12-18. http://www.australianprescriber.com/magazine/33/1/12/18/
3. al.] edited by Peter G. Gibson ; section editors, Michael Abramson ... [et Evidence-based respiratory medicine. — 1. publ.. — Oxford: Blackwell, 2005. — P. 321. — ISBN 978-0-7279-1605-1.
4. Jasmer RM, Nahid P, Hopewell PC (December 2002). «Clinical practice. Latent tuberculosis infection». N. Engl. J. Med. 347 (23): 1860–6. DOI:10.1056/NEJMcp021045. PMID 12466511.
5. Tuberculosis. World Health Organization (2007). Проверено 12 ноября 2009. Архивировано из первоисточника 24 августа 2011. Fact sheet No 104.
6. World Health Organization The Stop TB Strategy, case reports, treatment outcomes and estimates of TB burden // Global tuberculosis control: epidemiology, strategy, financing. — 2009. — P. 187–300. — ISBN 978 92 4 156380 2.
7. http://medi.ru/doc/9590305.htm Большой Целевой Журнал о туберкулёзе "" № 3 1999 Основы. К проблеме вакцинации BCG
8. Факторы риска развития заболевания туберкулезом у детей и подростков из социально-дезадаптированных групп населения
9. ЕРБ ВОЗ | Европейские государства-члены демонстрируют новую решимость в борьбе с лекарственно-устойчивыми формами туберкулеза
10. Вторичный туберкулез
11. W. Devitt Indications for Pneumothorax. Chest. 1936;2;8—26
12. WHO Disease and injury country estimates. World Health Organization (2004). Проверено 11 ноября 2009. Архивировано из первоисточника 20 августа 2011.
13. National Institute of Allergy and Infectious Diseases (NIAID). Microbes in Sickness and in Health. 26 October 2005. Retrieved on 3 October 2006. „According to the World Health Organization (WHO), nearly 2 billion people, one-third of the world’s population, have TB.“
14. Centers for Disease Control. Fact Sheet: Tuberculosis in the United States. (недоступная ссылка с 21-05-2013 (658 дней) — история, копия) 17 March 2005, Retrieved on 6 October 2006.
15. World Health Organization (WHO). Global Tuberculosis Control Report, 2006 (недоступная ссылка с 21-05-2013 (658 дней) — история, копия) — Annex 1 Profiles of high-burden countries. (PDF) Retrieved on 13 October 2006.
16. Centers for Disease Control and Prevention (CDC). 2005 Surveillance Slide Set. (September 12, 2006) Retrieved on 13 October 2006.
17. Davies PDO, Yew WW, Ganguly D, et al. (2006). «Smoking and tuberculosis: the epidemiological association and pathogenesis». Trans R Soc Trop Med Hyg 100: 291–8. PMID 16325875.
18. Restrepo BI (2007). «Convergence of the tuberculosis and diabetes epidemics: renewal of old acquaintances». Clin Infect Dis 45: 436–8.
19. Туберкулёз в России. Справка. РИА Новости (24 марта 2010). Проверено 14 августа 2010. Архивировано из первоисточника 24 августа 2011.
20. Бремя туберкулеза в России // Демоскоп Weekly 11 декабря 2011 "смертность от туберкулеза составляет около 70 % всех случаев, приходящихся на инфекционные и паразитарные болезни в России. "
21. Минздрав РФ (недоступная ссылка с 21-05-2013 (658 дней) — история, копия)
22. Туберкулёз. Лечение. Симптомы. Профилактика. Диагностика (фото+видео)» (недоступная ссылка с 21-05-2013 (658 дней) — история, копия)
23. Туберкулёз. Оценка ситуации | Медицинская газета «Здоровье Украины», Медицинское издание, медицинские издательства на Украине
24. Organització Mundial de la Salut (OMS). Global tuberculosis control — surveillance, planning, financing WHO Report 2006. Consultat el 13 d’octubre del 2006.
25. Справочник по клинической хирургии / Под ред. проф. В. И. Стручкова. — М.: "Медицина", 1967. — 520 с.
26. Список знаменитых людей, умерших от туберкулёза
27. Ортопедическая диагностика. Плечевой пояс и плечевой сустав.
28. Вакцина БЦЖ. Еженедельный эпидемиологический бюллетень ВОЗ (январь 2004). Проверено 7 ноября 2014.
29. Н.Г. Камаева и др. Клинико-эпидемиологические особенности туберкулезных оститов у детей, вакцинированных БЦЖ 16-20. Проблемы туберкулеза и болезней легких (2009). Проверено 7 ноября 2014.
30. Р.Я. Мешкова. Руководство по иммунопрофилактике для врачей. Проверено 7 ноября 2014.
31. Витамин B6: фармакодинамика и фармакокинетика
32. М. И. Перельман Консультант врача. Фтизиатрия. — М.: ГЭОТАР-Медиа, 2007. — С. 57-65. — ISBN 978-5-9704-1234-3.
33. Проф. А. И. Арутюнов, кандидат медицинских наук Н. Я. Васин и В. Л. Анзимиров Справочник по клинической хирургии / Проф. В.И. Стручкова. — Москва: Медицина, 1967. — С. 234. — 520 с. — 100 000 экз.
34. Тимофей Фрязинский "Венера туберкулёза". admarginem.ru. Проверено 10 ноября 2010. Архивировано из первоисточника 24 августа 2011.



